Medición del Calor:
Para lograr cálculos perfectos, la medición del calor se realiza a través del calorímetro, un instrumento que hace posible medir las cantidades de calor absorbidas o liberadas por los cuerpos. Obviamente, cuando pensamos en términos de medición del calor tendemos a pensar en un termómetro, pero esta es una concepción errónea.
Mientras el calorímetro puede medir el calor especifico y absoluto de un cuerpo, el termómetro no hace más que medir la temperatura, que responde a las nociones de los seres humanos sobre lo que es caliente y lo que es frío. El termómetro no permite medir transferencias de calor y por ende, no mide el calor en términos absolutos.
Igualmente, los termómetros son útiles porque, en general, deseamos medir el calor de acuerdo a nuestra concepción del mismo. Además, trabajan en diferentes escalas. Las escalas más conocidas por todos nosotros son las siguientes:
- Grado Celsius (ºC)
- Grado Fahrenheit (ºF)
- Grado Réaumur (ºRé)
Estas son escalas relativas, pero también existe una escala absoluta que es la de grados Kelvin (K). Nuestro tacto detecta la temperatura, pero carece de la capacidad de medirla con rigor.Del cuerpo que está a mayor temperatura decimos que "está más caliente" y a veces, erróneamente, se dice "que tiene más calor". Los cuerpos no tienen calor, tienen energía interna y tienen temperatura. Reservamos el término "calor" para la energía que se transfiere de un cuerpo a otro. Esta energía es fácil de medir, pero la energía total que tiene el cuerpo no.
Si un cuerpo recibe energía calorífica aumenta la agitación de las partículas que lo forman (átomos, moléculas o iones) y se pueden producir también cambios en la materia: dilatación, cambios de color (piensa en una barra de metal al calentarla), variación de su resistencia a la conducción, etc. Estos cambios se pueden utilizar para hacer una escala de temperatura.
Al poner en contacto dos sustancias la agitación de las partículas de una se transmite, mediante choques, a las partículas de la otra hasta que se igualan sus velocidades. Las partículas de la sustancia más caliente son más rápidas y poseen más energía. En cada impacto ceden parte de la energía a las partículas más lentas con las que entran en contacto. Las partículas de la sustancia que está a mayor T se frenan un poco, pero al mismo tiempo hacen que la más lentas aceleren.
Finalmente las partículas de las dos sustancias alcanzan la misma velocidad media y por lo tanto la misma temperatura: se alcanza el "equilibrio térmico".





 (minúscula).
(minúscula).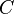 (mayúscula).
(mayúscula).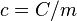 donde
donde 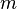 es la masa de la sustancia.
es la masa de la sustancia.